DISPOSIZIONE DEGLI ELETTRONI IN UN ATOMO
E
PRINCIPIO DI ESCLUSIONE DI PAULI
Il principio di esclusione di Pauli fu enunciato dal fisico austriaco Wolfgang Pauli nel 1925 e rappresenta uno dei principi fondamentali della Meccanica Quantistica.
Pur scaturendo dallo studio della struttura dell'atomo, tale principio ha avuto importanti conseguenze soprattutto nel campo della Chimica. Per comprenderlo e' necessario introdurre i numeri quantici, ossia una quaterna di valori, indicati con le lettere n, l, ml ed ms, che descrivono lo stato degli elettroni in un atomo.
Gli elettroni in un atomo non si muovono lungo orbite fisse attorno al nucleo, pioche', per il principio di indeterminazione di Heisenberg, e' impossibile stabilire contemporaneamente la posizione e la velocita' di un elettrone in un determinato istante; di ogni elettrone si puo' solamente definire lo spazio tridimensionale, intorno al nucleo, all'interno del quale si ha un'elevata probabilita' di trovarlo. E' come se l'elettrone si trovasse all'interno di una nube, chiamata orbitale, le cui dimensioni, forma ed orientamento spaziale vengono fornite rispettivamente dai tre numeri quantici n, l, ml, ottenibili dalla soluzione dell'equazione di Schrödinger.
Dunque, un orbitale puo' essere definito come quella zona di spazio intorno al nucleo nella quale vi e' un'alta probabilita' (piu' del 90%) di trovare l'elettrone.
I numeri quantici degli elettroni in un atomo
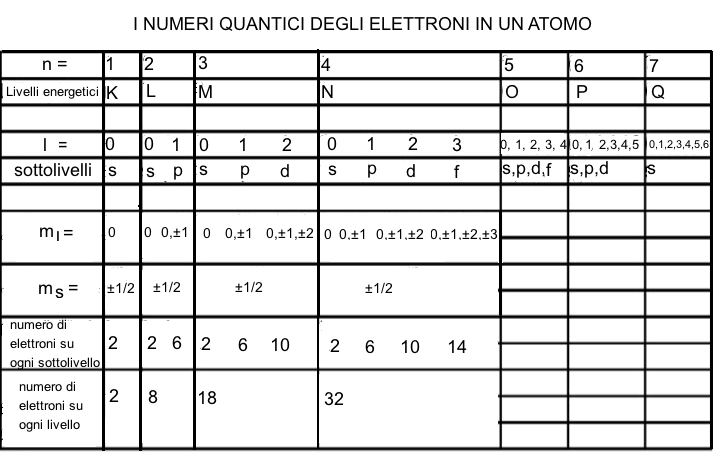
Il numero quantico principale n indica il livello di energia dell'elettrone e la dimensione degli orbitali atomici; all'aumentare del valore di n aumenta anche la dimensione dell'orbitale atomico. Il numero quantico n corrisponde sostanzialmente ad una delle orbite stazionarie individuate da Bohr; esso assume i valori interi e positivi 1,2,3,4... ai quali si fanno corrispondere rispettivamente le lettere K, L, M, N... per la denominazione del relativo livello energetico.
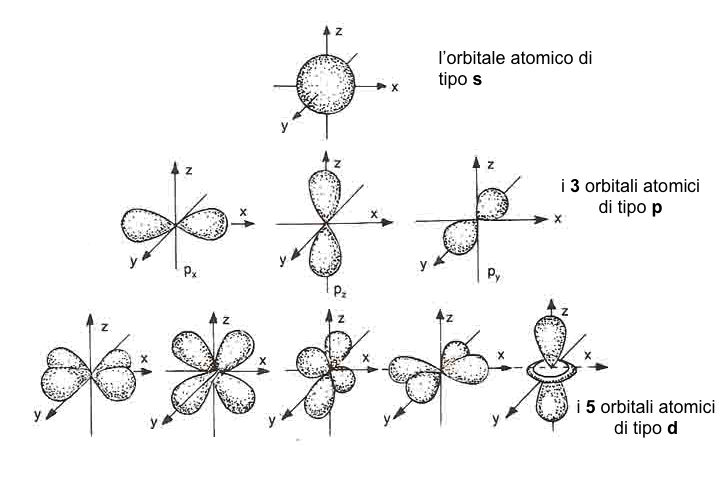
Il numero quantico secondario l, detto anche numero quantico azimutale o angolare, specifica la forma dell'orbitale atomico e puo' assumere tutti i valori da 0 a n-1. Ad ogni valore del numero quantico angolare corrisponde un sottolivello di energia, indicato rispettivamente con le lettere s,p,d,f..., cui corrisponde una ben precisa forma dell'orbitale atomico. Esempio:
per l=0 l'orbitale e' sferico (orbitale di tipo s) ed al centro della sfera c'e' il nucleo dell'atomo;
per l=1 l'orbitale e' a due lobi (orbitale di tipo p) ed al centro dei due lobi c'e' il nucleo dell'atomo;
per l=2 l'orbitale e' a quattro lobi (orbitale di tipo d) ed il nucleo dell'atomo e' al centro dei quattro lobi;
per l=3 l'orbitale e' a otto lobi (orbitale di tipo f);
per gli altri sottolivelli gli orbitali atomici presentano simmetrie piu' complesse.
Il numero quantico magnetico ml indica il numero di orbitali che possono coesistere in un determinato sottolivello. Tali orbitali hanno tutti la stessa energia, ma sono diversamente orientati nello spazio. Il numero quantico ml puo' assumere 2l+1 valori diversi da -l a +l.
Esempio:
il sottolivello s (corrispondente al valore l=0, primo sottolivello energetico) ammette un solo valore di ml (2x(0)+1=1), cioe' ml=0; questo valore indica la presenza, in quel sottolivello energetico, di un solo orbitale atomico il quale, essendo a simmetria sferica, non ha un orientamento prevalente nello spazio;
il sottolivello p (corrispondente al valore l=1) ammette 3 valori di ml (2x(1)+1=3), essi sono: ml=0,±1; questi valori indicano i tre orbitali atomici di tipo p disposti nello spazio lungo i tre assi x,y,z.
In figura e' riportata la forma ed il numero di orbitali atomici per i primi tre sottolivelli energetici:
Il numero quantico di spin ms, a differenza dei precedenti, e' una proprieta' intrinseca dell'elettrone; esso e' indipendente dagli altri numeri quantici e quindi non dipende dal livello energetico, sottolivello o orbitale cui l'elettrone appartiene. Questo numero quantico fa riferimento alla proprieta', posseduta da ciascun elettrone, di ruotare attorno al proprio asse oltre che intorno al nucleo.
I valori assegnati arbitrariamente allo spin di un elettrone sono:
+1/2 per una rotazione in senso orario;
-1/2 per una rotazione in senso antiorario.
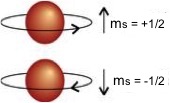
In figura ne e' data una rappresentazione:
 Lo
stato di spin di un elettrone e' rappresentato con una freccia
“up” per
il valore di ms=+1/2
e
con una freccia
“down” per
il valore di ms=-1/2.
Lo
stato di spin di un elettrone e' rappresentato con una freccia
“up” per
il valore di ms=+1/2
e
con una freccia
“down” per
il valore di ms=-1/2.
PRINCIPIO DI ESCLUSIONE DI PAULI
Esso afferma che:
in un atomo non si possono mai trovare due elettroni con la stessa quaterna di numeri quantici
In pratica, due elettroni che hanno la stessa serie di numeri quantici n, l ed ml (cioe' che occupano lo stesso orbitale atomico) non possono avere lo stesso valore del numero quantico di spin ms, ma devono avere spin opposto. Pertanto, ogni orbitale atomico puo' essere occupato al massimo da due elettroni con spin opposto.
La tabella riportata di seguito racchiude sinteticamente i numeri quantici degli elettroni atomici con il loro significato:

Calcolo del numero massimo di elettroni in un livello energetico
Per conoscere il numero massimo di elettroni in un determinato livello energetico e' necessario:
calcolare il numero di elettroni appartenenti a ciascun sottolivello di quel dato livello energetico. Per fare questo bisogna moltiplicare, per ciascun sottolivello, il numero di valori che puo' assumere il numero quantico ml per il numero di valori che puo' assumere ms;
sommare tra loro i valori calcolati del numero di elettroni di ciascun sottolivello del livello energetico considerato.
Esempio:
si prenda in considerazione il livello energetico con n=2 che possiede i due sottolivelli “s e p” e si determini il numero di elettroni appartenenti a ciascun sottolivello.
Calcolo del numero di elettroni nel sottolivello s: il valore che puo' assumere ml per il sottolivello s (l=0) e' uno solo ed e' ml=0 (nel sottolivello s vi e' un solo orbitale). L'operazione da fare per ottenere il numero di elettroni nel sottolivello s e' moltiplicare il numero di valori che puo' assumere ml (ossia 1 valore) per il numero di valori che puo' assumere ms (ossia 2 valori, ± ½): 1x2 = 2 elettroni.
Calcolo del numero di elettroni nel sottolivello p: i valori che puo' assumere ml per il sottolivello p (l=1) sono 3 e valgono ml=0,±1 (nel sottolivello p ci sono tre orbitali). L'operazione da fare per ottenere il numero di elettroni nel sottolivello p e' moltiplicare il numero di valori che puo' assumere ml (ossia 3 valori) per il numero di valori che puo' assumere ms (ossia 2 valori, ± ½): 3x2 = 6 elettroni.
Sommando tra loro i valori calcolati del numero di elettroni nei sottolivelli energetici s e p (cioe' 2+6), si ottiene che il numero massimo di elettroni nel secondo livello energetico, quello con n=2, e' uguale a 8.
La tabella riportata di seguito fornisce sia i valori dei numeri quantici degli elettroni atomici, sia il numero di elettroni che ciascun sottolivello e livello energetico puo' contenere:
Configurazione elettronica
La distribuzione degli elettroni di un atomo all'interno degli orbitali dei diversi livelli energetici viene definita configurazione elettronica dell'atomo e puo' essere rappresentata graficamente.
Nella rappresentazione grafica gli orbitali vengono di solito raffigurati con dei quadratini:
si utilizza un quadratino per rappresentare l'orbitale s;
si utilizzano tre quadratini uniti in fila per rappresentare gli orbitali p;
si utilizzano cinque quadratini per rappresentare gli orbitali d;
si utilizzano sette quadratini per rappresentare gli orbitali f.
Gli elettroni vengono rappresentati da frecce verticali, il cui verso indica lo stato di spin.
Ogni orbitale atomico puo' contenere 0, 1 o al massimo 2 elettroni. Se l'orbitale atomico e' occupato da due elettroni, le frecce che li rappresentano sono parallele, ma hanno verso opposto per indicare lo spin opposto. I sottolivelli p, d ed f, costituiti rispettivamente da 3, 5 e 7 orbitali atomici, devono essere riempiti inserendo prima un solo elettrone per orbitale e successivamente, dopo aver occupato tutti gli orbitali atomici del sottolivello, deve essere inserito il secondo elettrone con spin anti-parallelo al primo.
Esempi:
Atomo di azoto (N)
numero atomico: Z=7
configurazione elettronica: 1s2 2s2 2p3
rappresentazione
grafica:
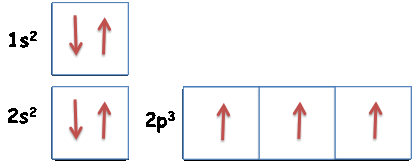
Spiegazione:
Primo livello energetico: n=1, l=0 (s), ml=0 → nel primo livello c'e' solo un orbitale di tipo s (1s)
Secondo
livello energetico: n=2,
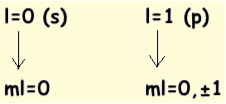 → nel secondo livello ci sono: un orbitale di tipo s (2s) e tre
orbitali di tipo p (2p)
→ nel secondo livello ci sono: un orbitale di tipo s (2s) e tre
orbitali di tipo p (2p)
Atomo di silicio (Si)
numero atomico: Z=14
configurazione elettronica: 1s2 2s2 2p6 3s2 3p2
rappresentazione
grafica:
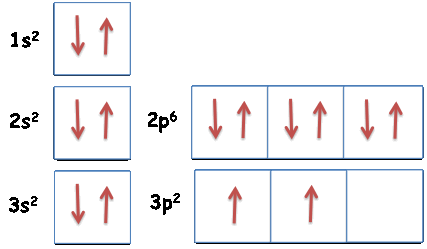
Riassumendo
Un orbitale atomico possiede:
una dimensione (volume);
una forma;
una direzione nello spazio (orientamento).
Ogni orbitale atomico e' caratterizzato da tre valori detti numeri quantici:
n = numero quantico principale (n° d'ordine del livello energetico); esso definisce il contenuto energetico e la dimensione dell'orbitale.
l = numero quantico secondario, determina la forma dell'orbitale.
ml = numero quantico magnetico, definisce il numero di orbitali atomici e ne specifica l'orientamento nello spazio.
Due elettroni che hanno la stessa serie di numeri quantici n, l ed ml (ossia che occupano lo stesso orbitale atomico) non possono avere lo stesso numero quantico di spin ms, ma devono avere spin opposto.
Principi fondamentali su cui si basa la teoria atomica moderna
Possono essere sintetizzati come segue:
Gli elettroni non sono solo particelle ma presentano anche carattere ondulatorio.
Gli elettroni non seguono orbite attorno al nucleo; ossia e' impossibile determinare la traiettoria di un elettrone.
Un elettrone puo' assumere solo particolari valori di energia; cio' significa che i livelli energetici degli elettroni non possono variare con continuita', ma sono quantizzati.
La teoria atomica moderna non consente di creare una semplice immagine mentale dell'atomo.